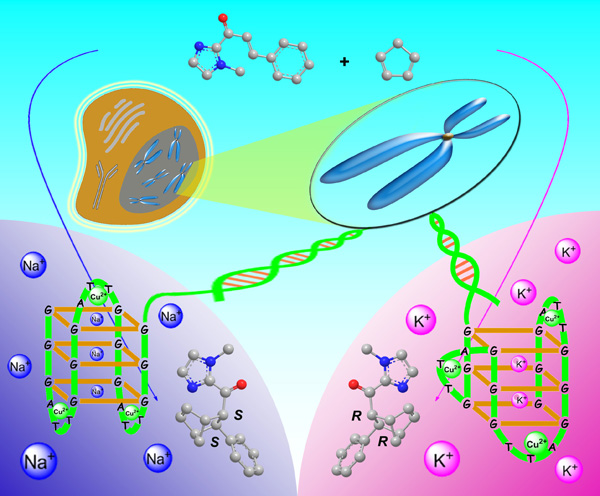
我组最近在DNA催化研究中观察到G-四链体DNA(G4DNA)金属酶催化的不对称Diels-Alder反应的手性选择性可以在含有Na+和K+的不同溶液中发生反转,相关研究结果近日以通讯形式发表在《化学通讯》(Chem. Commun., 2013, DOI: 10.1039/C3CC45396K)上,并被评为当期的Hot Paper。
金属离子(如Na+和K+等)在一系列的生命过程中扮演着重要的角色,例如Na+/K+ -三磷酸腺苷酶(Na+/K+-ATPase)就是利用细胞内外Na+和K+的浓度差来调节离子的传输。在自然界中,Na+和K+经常作为辅因子来稳固生物大分子(如蛋白质、RNA、DNA等)的结构和促进其生物功能。当Na+和K+和富含G碱基的单链DNA相互作用时,它们可以促使单链DNA形成紧凑的G-四链体结构,例如在Na+离子溶液中可以形成反平行的G-四链体结构,而在K+离子溶液中则形成杂化的G-四链体结构。尽管在含Na+、K+离子溶液中富G碱基的单链DNA可以形成丰富的G-四链体结构,但是关于在含Na+、K+离子溶液中G4DNA的催化研究还不多见,特别是其手性催化性能的研究更是鲜有报道。本研究发现人端粒G4DNA在K+存在下可以催化2-酰基咪唑类化合物和环戊二烯的不对称Diels-Alder反应。当G4DNA和Cu2+人工组装成G4DNA金属酶(G4DNA-Cu2+)后,其所催化的不对称Diels-Alder反应的手性选择性对不同的碱金属离子表现出不同的响应。当把碱金属离子由Na+换为K+时,G4DNA金属酶催化的Diels-Alder反应的手性选择性可以从+49%翻转为-56%。当Na+和K+共存时,发现G4DNA金属酶的手性催化性能对K+比Na+更敏感,并且随着不同的Na+/K+比例呈现可调变性能.
一直以来,双螺旋DNA被认为是“惰性”分子。但当双螺旋结构解离为单链结构时,就有可能形成具有潜在活性的三维结构。最近,英国剑桥大学的Balasubramanian等首次报道了在人体细胞中观察到G-四链体结构的存在,这为探索生物体内G4DNA的催化功能提供了基础。本研究是继我组报道人端粒G4DNA在氮杂查尔酮和环戊二烯的不对称Diels-Alder反应(Angew. Chem. Int. Ed. 2012, 51, 9352-9355)和2-酰基咪唑和吲哚的不对称Friedel-Crafts反应(Chem. Commun. 2012, 48, 6232-6234)中表现出手性催化功能之后,再一次证实G4DNA具有手性催化功能。这一系列关于G4DNA手性催化功能的研究对认识DNA的催化功能具有重要的借鉴意义,同时也有助于认识G-四链体作为潜在抗癌药物靶点和药物分子(尤其手性药物)的识别过程。(文:王长号 图:王长号 )
该工作得到了国家自然科学基金委(31000392)的资助。
Article
Changhao Wang, Guoqing Jia, Yinghao Li, Sufang Zhang and Can Li*
Chem. Commun., 2013, DOI: 10.1039/C3CC45396K
http://pubs.rsc.org/en/content/articlelanding/2013/cc/c3cc45396k#divAbstract